تولید اسیدسیتریک از کاه گندم به روش تخمیر حالت جامد
اکرم رویانی 1394/11/14 دسته بندی : علوم پایه 2|
عنوان تولید اسیدسیتریک از کاه گندم به روش تخمیر حالت جامد مقدمه اسيد سيتريك يك تري كربوكسيليك اسيد 6 كربنه با فرمول ساختماني زير است: نام شيميايي آن، 2- هيدروكسي 1 و 2 و 3 پروپان تري كربوكسيليك اسيد است.
فرمول شيميايي: اسيد سيتريك جزء طبيعي و متابوليت مشترك گياهان و حيوانات است و به صورت خيلي گسترده در صنايع غذايي، نوشيدني و دارويي و غيره استفاده ميشود. به علت دارا بودن گروههاي عاملي مختلف و قابليت زيست تخريب پذيري، اسيد سيتريك و نمكهاي آن (عمدتاً Na و K ) كاربردهاي صنعتي خيلي زياد در زمينههاي مختلف دارند.
1-1) پيشينه: اين اسيد اولين بار در سال 1784 توسط Scheel از آبليمو جداسازي و كريستاليه شد. اولين بار به طور تجاري در سال 1826 توسط John و Edmond sturge در انگلستان توليد گرديد. در سال 1869 در انگلستان از كلسيم سيتريت وارده در ايتاليا تهيه گرديد. سيترات كلسيم را يك كارتل دولتي ايتاليا به نرخ بالايي فروخته بود. اين قيمت بالا توسعة خريد سيترات كلسيم و توليد اسيد سيتريك را به تعويق انداخت. در سال 1880 اسيد سيرتيك توسط Adam و Grimux سنتز شد. از آن زمان تا حال روشهاي سنتزي متعددي ارائه شدهاند كه هيچ كدام به توليد صنعتي نرسيدهاند و دليل آن بازدهي كم و عدم توجيه اقتصادي اين روشها نسبت به ساير روشهاي توليد است. شروع توليد اسيد سيتريك به روش تخمير به سال 1893 بر مي گردد. زماني كه wehmer (گياهشناسي آلماني) تشخيص داد كه اسيد سيتريك متابوليت كپكهاي سيترومايسس ففريا نيز (citromyces pfefferionis) و سيترومايسس گلابر (glaber) است. كوشش هاي زياد wehmer براي توليد اسيد سيتريك ناموفق بودهاند تا اينكه كوري در سال 1917 توليد انبوه اسيد سيتريك به روش تخمير سطحي را با آسپرژيلوس نايجر پايهگذاري كرد. بعداً كوري به چاس فيرز پيوست و در سال 1923 كارخانة توليد اسيد سيتريك به روش جديد را راهاندازي كردند. اين تخمير با رشد ميكروارگانيسم به صورت كشت سطحي همراه بود. توليد ميكروبي اسيد سيتريك با روش كشت سطحي ادامه يافت تا اينكه اولين بار در سال 1951 فرآيند تخمير غوطهوري پيشرفته در ايالت متحده امريكا توسعه داده شد. ابداع اين فرآيند تحول عمده اي در توليد اسيد سيتريك ايجاد كرد. از سال 1965 به بعد پيشرفت به سمت معرفي فرآيندهايي بود كه در آن زمان از مخمرهاي خاصي براي توليد اسيد سيتريك استفاده شد. در اين فرآيندها ابتدا از كربوهيدراتها و سپس از آلكانهاي نرمال استفاده ميشد. البته زماني كه هيدروكربنها به عنوان مادة خام استفاده مي شدند، محصولات نفتي ارزان بودند و طبيعتاً توليد اسيد در آن شرايط از نظر اقتصادي مقرون به صرفه بود به طوري كه چاس فيرز پس از يك دوره استفاده از هيدروكربن به سمت استفاده از كربوهيدراتها تغيير جهت داد. علاوه بر اين، شركت Liquichimica در ايتالياي جنوبي كارخانة ديگري با ظرفيت توليد ساليانه 50 تن سيتر ات سديم از آلكانهاي نرمال، تأسيس كر د كه پس از دورة كوتاهي تعطيل شد. علاوه بر دو روش تخمير سطحي و غوطهور، روش كشت حالت جامد نيز براي توليد اسيد سيتريك قابل استفاده است. از اين روش بيشتر در كشورهاي آسيايي جنوب شرقي استفاده مي شود. به طوري كه هم اكنون 20% اسيد سيتريك مصرفي ژاپن از اين روش توليد مي شود. در سه دهه اخير تمايل فزايندهاي براي استفاده از مواد خام جامد و كم ارزش صورت گرفته است. عنوان تولید اسیدسیتریک از کاه گندم به روش تخمیر حالت جامد این فایل با فرمت ورد و آماده پرینت می باشد.
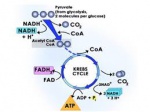
فهرست مندرجات عنوان صفحه ديباچه 1 فصل اول: شناخت كلي اسيد سيتريك 2 مقدمه 3 1-1) پيشينه 4 1-2) سوبستراهاي استفاده شده باي توليد اسيد سيتريك 6 1-3) خواص فيزيكي اسيد سيتريك 7 1-4) خواص شيميايي اسيد سيتريك 11 1-5) منابع طبيعي اسيد سيتريك 13 1-6) كاربرد اسيد سيتريك 15 1-7) مشتقات اسيد سيتريك 20 1-7-1) نمكها 20 1-7-2) استرها 21 فصل دوم: بيوشيمي تخمير و متابوليسم توليد اسيد سيتريك 23 2-1) بيوشيمي تخمير 24 2-2) بيو شيمي تخمير 24 2-2-1) تشكيل اسيد سيتريك از پيرووات 27 فصل سوم: روشهاي توليد اسيد سيتريك 31 3-1) M.O هاي مولد اسيد سيتريك 32 3-1-1) مخمرها 33 3-1-2) آسپرژيلوس نايجر 33 3-1-2-1) روش جداسازي سويه A.niger مولد اسيد سيتريك 34 3-1-2-2) شناسايي اختصاصي A.niger 35 3-2) روش كشت سطحي 37 3-3) روش كشت غوطهور 37 3-4) تخمير در بستر جامد 38 3-4-1) روش تخمير كوجي 38 3-5) تأثير شرايط محيطي بر توليد اسيد سيتريك 39 3-5-1) شرايط تغذيهاي A.niger 39 3-5-2) تأثير فلزات trace در توليد اسيد سيتريك 40 3-5-3) تأثير نيتروژن و فسفر در توليد اسيد سيتريك 40 3-5-4) تأثير متانول در توليد اسيد سيتريك 41 فصل چهارم: تخمير در بستر جامد (SSF) 42 4-1) تعريف كشت حالت جامد 43 4-2) تفاوتهاي اساسي بين كشت حالت جامد و كشت غوطه ور 44 4-3) مقايسة كشت حالت جامد با ساير فرآيندهاي تخميري 46 4-4) مزايايي سيستم كشت حالت جامد 48 4-5) معايب سيستم كشت حالت جامد 48 4-6) مراحل اصلي فرآيند كشت حالت جامد 49 4-7) پارامترهاي مؤثر بر فرايند SSF در توليد اسيد سيتريك 50 فصل پنجم: كاه گندم 52 5-1) تعريف كاه و ويژگيهاي ساختاري 53 5-1-1) كربوهيدراتهاي ساختماني 54 5-1-1-1) سلولز 54 5-1-1-2) همي سلولز 55 5-1-1-2) ليگنين 55 5-2) تركيب شيميايي كاه گندم 59 5-3) پيش تيمار (Pretreatment) كاه گندم 59 5-3-1) روشهاي فيزيكي پيش تيمار كاه گندم 60 5-3-1-1) پيش تيمار كاه گندم با بخار 60 5-3-2) روشهاي شيميايي پيش تيمار كاه گندم 61 5-3-2-1) پيش تيمار كاه با اوره 63 5-3-3) پيش تيمار بيولوژيكي كاه گندم 63 فصل ششم: جداسازي و خالصسازي اسيد سيتريك 64 6-1) استخراج اسيد سيتريك 65 6-1-1) فروشويي (Leaching) 65 6-1-2) روش رسوبگيري 66 6-1-3) روش استفاده از استخراج با حلال 68 6-1-4) روش استفاده از غشاء 69 6-1-5) مقايسه بين روشهاي مختلف جداسازي اسيد 70 6-2) خالص سازي اسيد سيتريك 71 فصل هفتم: بررسي جنبة اقتصادي 73 7-1) كشورهاي عمدة توليد كننده و مصرف كنندة محصول 74 7-2) اهميت اقتصادي طرح 74 7-3) ميزان واردات اسيد سيتريك 75 7-4) واحدهاي توليدي و واحدهاي در دست اجراي اسيد سيتريك 78 منابع مورد استفاده 81
ديباچه توليد اسيدهاي آلي به دليل كاربرد وسيع آنها در صنايع مختلف از ديرباز مورد مطالعه و بررسي بوده است. از جمله اسيدهاي آلي مورد استفاده، اسيد سيتريك است كه داراي مصارف متعددي در صنايع غذايي، دارويي، بهداشتي و ساير صنايع ميباشد كه به دليل غيرسمي بودن، اسيديتة مناسب، قابليت بافري و . . . هر سال به مقدار %2-3 بر ميزان مصرف آن افزوده ميگردد. از اولين كشورهايي كه در اين زمينه تلاش كردند، ايتاليا، آمريكا، انگلستان و چند كشور اروپايي بودند كه در قرون 18 و 19 به روش شيميايي اقدام به اين عمل نمودند و تقريباً از اوايل قرن 20 روشهاي بيوتكنولوژي در سراسر دنيا رايج شدند كه هنوز هم كاربرد دارند. ابتدا روش بستر جامد براي توليد آن استفاده ميشد ولي به تدريج روش غوطه وري جايگزين روشهاي قبلي شد زيرا در روش غوطهوري كنترل بهتر و آسانتر صورت گرفته و نيز شرايط كار بهتر و راندمان بيشتر ميباشد. مجدداً پس از طي چند دهه روش بستر جامد براي توليد اين اسيد به دليل امكان استفاده از ضايعات فراوان و ارزان كشاورزي به عنوان سوبسترا رواج يافت. به هر حال در سالهاي اخير تلاشهاي فراواني براي اصلاح گونههاي ميكروبي مولد اسيد سيتريك مخصوصاً آسپرژيلوس نايجر صورت گرفته و از جهت افزايش راندمان توليد و استخراج اسيد نيز مورد توجه بوده است.
1-2) سوبستراهاي استفاده شده براي توليد اسيد سيتريك سوبسترا سال توليد اسيد ملاس و با گاس هندي 1977 شيرة خرما 1977 تفالة سيب 1984 و 1988 تفالة انگور 1986 پوست كيوي 1987 لجن فشردة نيشكر 1992 ضايعات قهوه 1993 ضايعات آناناس 1994 Kumara 1997 و 1998 Carob pod 1999 ضايعات كارخانة توليد صدف 1997 چوب ذرت 1998 Cassave bagasse 2000 Okara 1996 ضايعات كارخانة آبجوسازي 1986 ملاس چغندر قند 1991 روغن آفتابگردان 2003 نشاستة خام 2002 n-paraffin 2004 آب پنير
1-3) خواص فيزيكي اسيد سيتريك اسيد سيتريك بيآب به صورت كريستالهاي شفاف بيرنگ يا پودر كريستالي سفيد است كه به طبقه بلورهاي منظم الاضلاع سيستم حاوي سه محور غيرمساوي با تقاطع اريب تعلق دارد. هر دو شكل تحت شرايط رطوبت معمولي وجود دارند، آبگيري از شكل تك آبه در هواي خيلي خشك اتفاق مي افتد و تحت خلأ در حضور اسيد سولفوريك غليظ اين عمل سريعتر رخ مي دهد. بلورهاي بدون آب به تدريج در هواي مرطوب، آب را جذب مي نمايند. هر دو فرم بلورين تشكيل كلوخه داده و در هواي مرطوب سخت مي شوند. حلاليت اسيد سيتريك در آب تابعي از دماست . PH محلولهاي اسيد سيتريك به صورت تابعي از غلظت در شكل (1-2) نشان داده شده است. نقاط انجماد و جوش محلولهاي اسيد سيتريك نيز در جدول (1-1) داده شده است. ثوابت تفكيك اسيد در به قرار زير ميباشند: و و
فرمول مولكولي
وزن مولكولي 192.13 وزن اكي والان گرم 64.04 نقطة ذوب
دماي تخريب گرمايي
جرم حجمي
گرماي احتراق در
گرماي انحلال
جدول (1-4): حلاليت اسيد سيتريك بدون آب دما محلول اشباع در آب 10 54 20 59.2 30 64.3 40 68.6 50 70.9 60 73.5 70 76.2 80 78.8 90 81.4 100 84.0
غلظت PH چگالي در
0.1 2.8 - 0.5 2.4 - 01.0 2.2 - 5.0 1.9 - 10.0 1.7 1.035 20.0 - 1.084 30.0 1.2 1.131 40.0 - 1.182 50.0 5.8 2.243 60.0 - 1.294 جدول (1-5): PH و چگالي محلولهاي آبي اسيد سيتريك اسيد سيتريك o.lm mlit سيترات سديم O.lm mlit Ph محلول بافر 46.5 3.5 3.0 33.0 17.0 4.0 20.5 29.5 5.0 9.5 41.5 6.0 جدول (1-6): محلولهاي بافر اسيد سيتريك
اسيد سيتريك اسيد ضعيف با ثابتهاي يونيزاسيون و و در است . لذا وقتي به صور ت جزئي در آب حل مي شود، سيستمهاي بافري خيلي عالي تشكيل مي دهد كه در جدول بالا به آن اشاره شده است. اسيد سيتريك يك آبه با وزن مولكولي 210.14 از محلول آبي سرد، كريستاله ميشود. اين شكل از اسيد وقتي به آرامي حرارت داده ميشود، در دماي آب خود را از دست داده و در محدودة دمايي ذوب ميشود.
1-4) خواص شيميايي اسيد سيتريك اسيد سيتريك در دماي با از دست دادن آب به شكل اسيد آكونيتيك و با حذف دي اكسيد كربن به انيدريد ايتاكونيك تبديل مي شود. انيدريد ايتاكونيك به انيدريد سيتراكونيك باز آرايي ميشود يا با آبگيري به شكل اسيد ايتاكونيك در ميآيد. افزايش آب به انيدريد ايتاكونيك خشك شده، اسيد سيتراكونيك سيس را ميدهد. تبخير محلول اسيد سيتراكونيك در حضور اسيد نيتريك، ايزومرترانس اسيد سيتراكونيك يعني اسيد ميزاكونيك را ايجاد مينمايد. اكسيداسيون اسيد سيتريك در دماي با پرمنگنات پتاسيم، 1 و 3- استن دي كربوكسيليك اسيد را توليد مي نمايد. در محصول، اسيد اگزاليك است. ذوب اسيد سيتريك با هيدوركسيد پتاسيم، اسيدهاي اگزاليك و استيك را بوجود ميآورد. اسيد سيتريك بلورهاي نمك يك، دو و سه بازي را با بسياري از كاتيونها تشكيل مي دهد. درجه هيدراسيون اين نمكها متغير است. تري سديم سولفات مي تواند با 2 يا 5/5 مولكول آب كريستاله شود. مخلوط شدن آن با كاتيونهاي فلزي ، نمكهاي كمپلكس نظير و و ايجاد مي نمايد. اسيد سيتريك با بسياري از فلزات تشكيل كمپلكس هاي پايداري مثل فروآمونيوم سيتراتها را مي دهد كه مي توانند كريستاله شوند. با بسياري از يونهاي فلزي در محلول، بوسيلة تشكيل پيوند بين فلز و گروههاي كربوكسيل يا هيدروكسيل مي تواند شلات ايجاد كند. گاهي اوقات تعدادي مولكول يا بيشتر اسيد سيتريك در بر هم كنش با يونهاي فلزي تجمع مييابند. اين خصوصيت براي هدايت رسوب دهي، تغيير پتانسيل شيميايي و ديگر خصوصيات شيميايي، ارزشمند است. اسيد سيتريك به آساني با بسياري از الكلها تحت شرايط معمولي در حضور كاتاليزورهايي نظير اسيد سولفوريك، پاراتولوئن، سولفونيك اسيد، يك رزين تعويض يون، استري ميشود. كلريدهاي اسيدي و انيدريدها با گروههاي هيدروكسيل اسيد سيتريك واكنش مي دهند. اپوكسايدها نظير اكسيداتيلن، اكسيد پروپيلن و اكسيداستيرن طي واكنش با اسيد سيتريك يا استرهاي آن در گروههاي قابل دسترسي هيدروكسيل و كربوكسيل تشكيل پليمر مي دهند. آمونياك، آمينها، آميدها و كرباميدها به همان صورت واكنش با اسيدهاي كربوكسيليك ساده، با اسيد سيتريك وارد واكنش مي شوند. 1-5) منابع طبيعي اسيد سيتريك اسيد سيتريك به صورت گسترده در گياهان و جانوران وجود دارد. اسيد سيتريك كل سرم خون انسان تقريباً 1 وزن بدن انسان است. جدول (1-7): ميزان اسيد سيتريك در چند گياه و ميوه نوع ميوه درصد وزن اسيد سيتريك مارچوبه 0.08-0.2 شلغم 0.05-101 نخود 0.05 دانه ذرت 0.02 كاهو 0.016 بادنجان 0.01 انگور فرنگي 1.0 تمشك 1.0-1.3 توت فرنگي 0.6-0.8 سيب 0.008 سيبزميني 0.3-0.5 گوجه فرنگي 0.25 ليمو 4-8 گريپ فروت 1.2-2.1 نارنگي 0.9-1.2 پرتقال 0.6-1.0 انگور سياه 1.5-3 انگور قرمز 0.7-1.3
جدول (1-8) اسيد ستريك موجود در تعدادي از نسوج و مايعات بدن انسان نوع نسج يا مايع ميزان يون سيترات (ppm) مايع نخائي 25-50 كليه 20 استخوان 7500 ترشحات بيني 17-100 آب دهان 2-24 اشك 5-7 عرق 1-2 خون 15 پلاسماي خون 25 گلبولهاي قرمز 10 شير 500-1250 ادرار 100-750 غدة پستان 3000 غدة تيروئيد 750-900
1-6) كاربرد اسيد سيتريك همانطور كه اشاره شد، اسيد سيتريك به دو شكل بدون آب و يك آبه توليد مي شود. دماي انتقال بين دو فر م است. شكل بدون آب توسط كريستاليزاسيون از محلولهاي آبي داغ بدست ميآيد، در حاليكه شكل يك آبه توسط كريستاليزاسيون در دماي كمتر از بدست مي آيد. هر دو صورت در صنعت مصرف مي شوند. ميزان كاربردهاي اسيد سيتريك در صنايع مختلف عبارتند از : غذا، شيريني و نوشابهسازي 75% ، داروسازي 10% و ساير صنايع 15% و در غذا، شيريني و نوشابهسازي بيشتر مصرف داشته و به طور وسيع براي ترشي كردن فرآوردههاي غذايي استفاده ميشود. ميزان استفاده از آن به عنوان پايدار كننده روغنها و چربيها منجر ميشود. از محلول اسيد سيتريك در تميز كردن بويلرهاي ايستگاه قدرت و تجهيزات مشابه استفاده ميشود. جايي كه در شويندهها روي فسفات محدوديت وجود دارد، تري سديم سيترات در تميز كنندههاي ويژه و آبهاي سخت جايگزين مي شود. سيترات آمونيوم آهن هنوز در درمان كم خوني استفاده ميشود، اگر چه ساير نمكهاي آهن به طور فزايندهاي ترجيح دارند. مخلوطي از اسيد سيتريك و نمكهاي آن داراي ظرفيت بافري خوبي هستند و بوفور در داروسازي، صنايع غذايي و آرايشي استفاده ميشوند. براي حذف دي اكسيد گوگرد خارج شده از دودكش ايستگاههاي قدرت پيشنهاد شده از اسيد سيتريك استفاده شود. محلول بافري شامل نمك سيترات به عنوان يك عامل ضدعفوني كننده مورد استفاده قرار مي گيرد. استرهاي اسيد سيتريك حاصل از واكنش با طيف وسيعي از الكلها شناخته شدهاند. بويژه استرهاي تري اتيل، تري بوتيل و استيل تري بوتيل به عنوان نرمكنندههاي غيرسمي در روكشهاي پلاستيكي براي محافظت مواد غذايي استفاده مي شود. از كاربردهاي ديگر اسيد سيتريك مي توان به موارد ذيل اشاره نمود: 1- نوشابه هاي الكلي و شربتها: اسيد سيتريك به دليل طعم ترش مطبوع، كمك به جوشش و كربناسيون به عنوان نگاهدارنده در شربتها و نوشابهها مورد استفاده قرار مي گيرد. اين اسيد همچنين سبب جدا شدن فلزات كه ايجاد تيرگي نموده و سبب تسريع فساد و رنگ و طعم مي شوند، ميگردد. 2- عصاره ميوهجات و سبزيجات: به طور كلي مقادير پايين PH، يك اثر حفاظتي بر روي پيگمانهاي آب ميوه جات اعمال مي نمايد. وجود اسيد سيتريك در عصاره ميوهجات و سبزيجات و نهايتاً افت PH سبب افزايش مقاومت در برابر فساد مي گردد. در آب گوجه فرنگي توسط افزودن اسيد سيتريك به ميزان %0.1 از رشد ميكروارگانيسمهاي flatsour كه سبب از بين رفتن طعم مي گردند، جلوگيري مي شود. همچنين طعم طبيعي عصاره گريب فروت و ساير ميوهجات به علت طعم ترش و مطبوعي كه اسيد سيتريك ايجاد مي كند، تشديد مي شود. 3- شيريني جات: اسيد سيتريك به منظور تشديد طعم ميوههاي مختلف مانند توت فرنگي، شاتوت و انگور در شيريني پزي و بخصوص آبنباتسازي استفاده مي شود. در موارد بسياري به علت حلاليت كم ساكيارز نسبت به قندهاي احياء بهتر است كه ساكارز به دو قند ساده دكستروز و Lerulose هيدروليز شود. اضافه نمودن اسيد سيتريك در خلال فرآيند پخت سبب هيدروليز ساكارز به قندهاي ساده كه به آساني كريستال نميشوند، ميگردد. 4- دسرها: در صنعت دسرهاي ژلاتيني، كنترل PH از اهميت خاصي برخودار ميباشد. زيرا كه كيفيت ژلاتين تابع مقادير PH است. اسيد سيتريك نه تنها PH را در اپتيمم مقدار خود يعني 2-3.5 تنظيم مينمايد، بلكه طعم مطبوعي ايجاد مي نمايد. حلاليت بالا و غيرسمي بودن اسيد سيتريك نيز در اين صنعت اهميت بسيار زياد دارد. 5- ژله و مرباجات: اسيد سيتريك، PH ژلهها و مرباجات را به نحوي تنظيم مي نمايد كه پكتين بتواند به خوبي عمل نمايد. اضافه نمودن اسيد سيتريك پس از تغليظ نمودن مخلوط پخته شده قند، پكتين و عصاره ژله صورت مي گيرد. مقدار اسيد سيتريك مصرفي بسته به نوع و خصوصيات پكتين متفاوت است.
|
خرید و دانلود | 3,500 تومان نوع فایل :WORD | تعداد صفحات :88 گزارش تخلف به پلیس سایت |

